기사상세페이지
식품의약품안전처는
첨단바이오의약품의 개발을 지원하기 위한 가이드라인 2종을 제정 및 개정 하고 임상시험 신청 시 자료 준비에
도움을 줄 수 있도록 하는 규제과학 상담사례집을 발간했다고 밝혔다.
이번 가이드라인 제·개정이 우수한 첨단바이오의약품의
개발을 지원하고 합리적인 품질관리를 수행하는 데 도움을 줄 것으로 기대된다.
첫째, ‘개인 맞춤형 신생항원 치료제 개발시 고려사항’을
제정했다. 최근
환자 개인의 신생항원을 사용한 항암제 개발이 증가함에 따라 치료제개발 시 필요한 고려사항을 안내하는 가이드라인을 선제적으로 마련했다.
신생항원이란 암세포의 DNA에
특정 돌연변이가 발생해 정상세포에서는 발현하지 않고 암세포에서만 선별적으로 발현하는 새로운 단백질을 의미한다. 기존
항암제와 달리 개인별 맞춤형으로 제조되는 특성을 반영하여 종양조직 채취부터 신생항원 제조까지 품질평가 방법, 비임상및임상 시험 시 고려사항 등을 제시했다.
둘째, ‘세포치료제 세포은행 평가 민원인 안내서’를
개정했다. 세포치료제는 소규모로 제조되기 때문에 세포은행을 자주 구축 및 변경해야 하는 어려움이 있으므로 세포은행 구축 의무 대상을 명확하게 제시하여
개발자의 부담을 줄이기 위해 관련 가이드라인을 개정했다.
세포은행은 특성이 규명된 세포를 동일한 조건에서 배양하여 얻은 균질한
세포를 여러 개의 용기에 같은 양으로 나눠 담고 정해진 조건에서 보관하는 것으로 제조의 일관성을 확보하기 위해 운영한다. 세포원액 품질관리 기준 적절성 등 과학적 근거와 해외 사례를 기반으로 제조 규모가 작은 세포치료제의 경우 세포은행
구축에 대한 예외를 적용받도록 했다.
아울러
1인의 기증자로부터 소량의 완제의약품을 생산할 경우 세포은행을구축하는 대신 기증자간 동등성 평가 등 과학적 근거를 통해 세포원액으로설정하여 품질관리 하도록 하고 그 타당성과 변경 관리계획에 대해서는식약처와 사전에 협의하도록 했다.
셋째, ‘첨단바이오의약품 규제과학 상담사례집’을
발간했다. 첨단바이오의약품의 신속한 임상시험을 지원하기 위해 신청 시 제출해야 하는
자료 관련 질의와 답변, 그리고 다양한 상담 사례를 구체적으로 안내했다.
식약처 관계자는 “이번 안내서 제·개정이 우수한 첨단바이오의약품의 개발을 지원하고 합리적인 품질관리를 수행하는 데 도움을 줄 것으로 기대한다”며
“앞으로도 전문성과
규제과학을 바탕으로 첨단바이오의약품의 제품화를 적극지원하도록 노력할 계획”이라고
밝혔다.
자세한 내용은 ‘식약처 누리집(mfds.go.kr) > 법령/자료 > 자료실 > 안내서/지침’에서 확인할 수 있다.

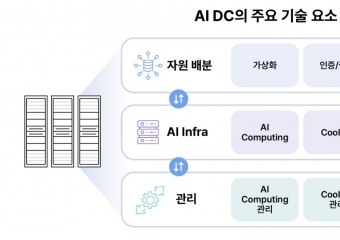
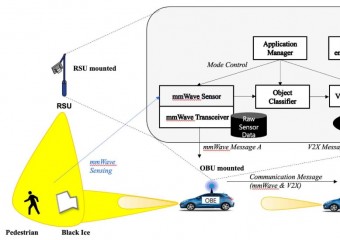

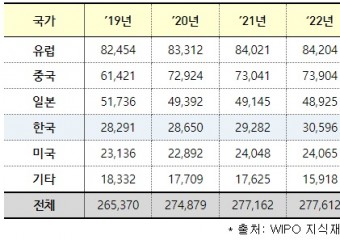
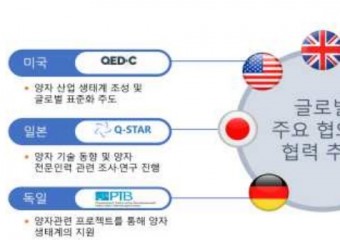
![[특집-ISO/IEC JTC 1/SC 17 활동] 35. Result of voting on SR Ballot for ISO/](http://www.stdnews.kr/data/file/news/thumb/thumb-3555379571_4cufp2BH_756bcefa64e6169e58646ad7b061ecbec455fb11_340x240.jpg)
![[특집-ISO/IEC JTC 1/SC 17 활동] 34. Result of voting on SR ballot for ISO/](http://www.stdnews.kr/data/file/news/thumb/thumb-3555380113_kIQxAlfN_727cc6e35ccb9d5e6c07574a3b3a2ab9db104d48_340x240.jpg)
![[특집-ISO/IEC JTC 1/SC 17 활동] 33. Result of voting on SR ballot for ISO/](http://www.stdnews.kr/data/file/news/thumb/thumb-32068165_R52GPIij_2bca2660198a937d2534db7bfd9fc8174a76cfa2_340x240.jpg)
![[특집-ISO/IEC JTC 1/SC 17 활동] 32. Result of voting on SR Ballot for ISO/](http://www.stdnews.kr/data/file/news/thumb/thumb-32068165_TxRrtYEa_c36d1a53acc15db7e18fae132ffef64e11bda43c_340x240.jpg)
![[특집-ISO/IEC JTC 1/SC 17 활동] 31. Result of voting on SR Ballot for ISO/](http://www.stdnews.kr/data/file/news/thumb/thumb-3555377690_nrjmWhSf_d9b63299e7f3f52053141cae28f32f7df40b5918_340x240.jpg)
![[일본] 요코하마(横浜), 3월 원격근무로 일하는 50대 여성이 장시간 노동을 강요받아 적응장애가 발병해 산재로 인정받아](http://www.stdnews.kr/data/file/news/thumb/thumb-3555377672_BapV2SmF_41a011a26290be1daa3f6a5220df7b8b6d167f69_340x240.jpg)
![[인도] 마하라슈트라주 식품의약국(Maharashtra FDA), 맥도날드 상품명에 치즈를 잘못 표기해 소비자 기만 지적](http://www.stdnews.kr/data/file/news/thumb/thumb-3743818281_Uu5GpcKZ_6890f33f4b087f58686ed20e46a04bbb79ad883e_340x240.jpg)
![[남아공] 토코만 푸드(Thokoman Foods), 자사 땅콩버터 식품 안전성 재확인](http://www.stdnews.kr/data/file/news/thumb/thumb-3743818281_h5HrK0kT_c2453abdb4577a16b34590f5b8f76de9c2a95469_340x240.jpg)
![[일본] 혼다(ホンダ), 2030년까지 전기자동차(EV)를 중심으로 하는 전동화와 소트프웨어 개발에 10조 엔을 투자할 계획](http://www.stdnews.kr/data/file/news/thumb/thumb-3555381172_1g5z7YDN_4db7699b271b5e9dbbe1a4f6dc69fb01a9881abb_340x240.jpg)
![[일본] 자민당(自民党), 기업이 직원을 고객의 '카스하라(カスハラ)로부터 보호를 의무로 하는 방안을 고려 중](http://www.stdnews.kr/data/file/news/thumb/thumb-3555381172_PCNyaL1v_9f9b79d526b4be07024401e874fe26f618a42e7c_340x240.jpg)
![[일본] 총무성(総務省), 2023년 기준 전국의 빈집은 900만 호로 사상 최고치 기록](http://www.stdnews.kr/data/file/news/thumb/thumb-3555379571_qr01mWC9_fef7fa874e596585a04ee2dae235376595341779_340x240.jpg)
![[특집-기상기후재난] 한국중부발전(주) 신정철 선임 인터뷰 - 행정안전부 뿐 아니라 기상기후 연계조직 모두가 참여하는 협의체가](http://www.stdnews.kr/data/file/news/thumb/thumb-3555374516_iKWwUBas_9c1729f1e3977ee50c398986e7f98d5002a57deb_340x240.jpg)
![[특집-기상기후재난] (주)비밍코어 정성민 대표 인터뷰 - 인공지능(AI) 활용한 기후재난 대처 솔루션 개발](http://www.stdnews.kr/data/file/news/thumb/thumb-3555374391_0JZYhIcj_dca23c54fc7923952082a9d7af92db00b9dd33c9_340x240.jpg)
![[기획-표준 전문가] 한국투자증권 김범수 FC 인터뷰 - 표준전문가 양성 교육이 지속되길 희망](http://www.stdnews.kr/data/file/news/thumb/thumb-3555374114_Np9hM7aC_e6ffa916aade15e1c301badf3132ed3f0551a900_340x240.jpg)
![[특집-기상기후재난] 행정안전부 안전교육 전문인력 유정희 강사 인터뷰 - 기상기후재난예방 전문가 양성 시급](http://www.stdnews.kr/data/file/news/thumb/thumb-3555374240_gOmdLG10_cfc17ed887dccc93f503013bf794ed568a5d40dc_340x240.jpg)
![[특집-기상기후재난] (주)이토스 김형식 대표 인터뷰 - 재난을 사전에 예측·예방할 기술개발 시급](http://www.stdnews.kr/data/file/news/thumb/thumb-32068165_lmUrCBIn_797dc8926bb7d90542546463cc73e6233f0bbb46_340x240.png)
게시물 댓글 0개